目次
実験概要
主な準備物
細胞膜を結合させるSPAビーズ一覧
35S-γ-GTP製品
プロトコル概要
アッセイの最適化
35S-γ-GTP結合アッセイの推奨条件
その他の情報
ヒント
データ分析
引用文献
実験概要
放射性同位元素が崩壊し、放出される放射線の到達距離以内にSPAビーズが存在した場合のみ、SPAビーズは発光し、計数が可能となります。
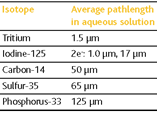
放射線が水中を進む距離は、そのエネルギーの強さ、つまり核種の種類に依存しています。たとえば3Hでは放出されるβ線が蛍光物質(シンチレータ)を励起できる距離は1.5µmであり、この距離内でSPAビーズ上の受容体と放射性標識リガンドが結合した場合のみシグナルを生じます。一方でアッセイバッファー中に浮遊する放射性標識リガンドはシグナルを生じません。このため、B/F(結合型B、遊離型F)分離操作なしにリガンド-受容体結合アッセイを行うことができます。
SPAを使った検出には3Hあるいは125I が適しますが、下記の表に示す核種でも測定が可能です。ただし、33Pはβ 線エネルギーが高いので、バックグラウンドを下げるために洗浄操作が必要となる場合があります。
リガンド-受容体結合アッセイの他、酵素活性測定、分子間相互作用の検出やラジオイムノアッセイなど、多岐にわたるアプリケーションがあります。

SPAアッセイ
主な準備物
・目的とする受容体を発現する細胞膜
・35S-γ-GTP
・非標識の非加水分解性GTPコントロール(非特異的結合を測定するための)
・GDP、アゴニスト、アンタゴニスト、試験化合物
・Wheatgerm agglutinin (WGA)コーティングされたSPAビーズ
(35S-γ-GTPを使用する場合は、ポリエチレンイミン(PEI)コーティングビーズの使用はお勧めしません。)
・検出機器
細胞膜を結合させるSPAビーズ
標準のSPAシンチレーションビーズに加えて、SPAイメージングビーズも提供しています。
SPAシンチレーションビーズおよびSPAイメージングビーズの詳細についてはこちらをご参照下さい。
SPAシンチレーションビーズの概要
SPAシンチレーションビーズは青色光を発するシンチレータを含んでいる微小粒子であり、シンチレーションカウンタで測定ができます。SPAシンチレーションビーズには、蛍光物質として9,10-ジフェニルアントラセンを含むポリビニルトルエン(PVT: 4.3-5.3µm, d=1.05g/cm3)あるいは、セリウムを含むケイ酸イットリウム(YSi: 体積平均径2.9µm, d=4.1g/cm3)ビーズの二種類があります。
一般的に使用されるSPAビーズは、WGAコーティングPVTシンチレーションSPAビーズです。PVT は沈降が穏やかなため、自動分注器によるハイスループット化に適しています。
YSi はPVTよりも約1.5倍計数効率が高いため、更なるカウント、感度の必要なアッセイに適しています。
SPA イメージングビーズの概要
SPA イメージングビーズは、赤色光を発するシンチレータを含んでいる微小粒子です。スクリーニングに提供される化合物の中には、黄色~茶色に着色していて青色光を吸収するものが存在します。SPAイメージングビーズは極大発光波長が615nmですので、この吸収の影響を受けません。SPAイメージングビーズには、ユーロピウムを含む酸化イットリウム(YOx)あるいはポリスチレン (PS)ビーズの二種類があります。
YOx(平均粒径2.7µm、密度5g/cm3)は更なるカウント、感度の必要なアッセイに適しています。
PSは粒径2.8-3.2µm、密度が1.05g/cm3で水溶液中での沈降が緩やかなため、自動分注器によるハイスループット化に適しています。

35S-γ-GTP製品
2種類の35S-γ-GTP製品が入手可能です。
| Product number | Radioactive concentration | Specific activity | Buffer |
| NEG030H | 462.5 MBq/mL | 46.2 TBq/mmol | 10 mM Tricine pH 7.6, 10 mM DTT |
| NEG030X | 37 MBq/mL | 46.2 TBq/mmol | 10 mM Tricine pH 7.6, 10 mM DTT |
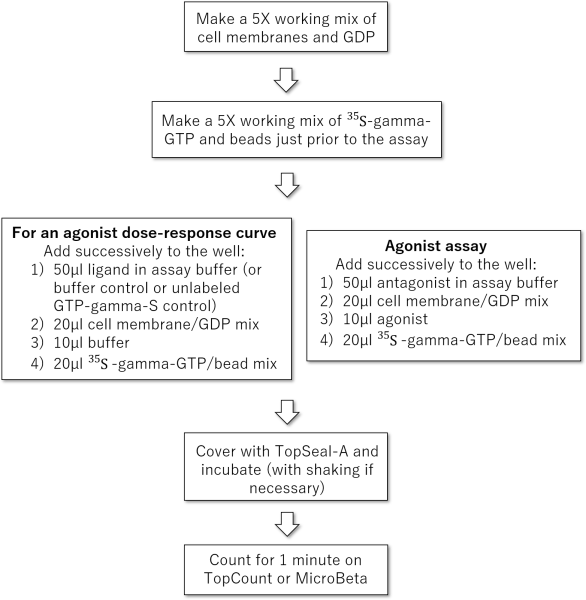
プロトコル概要
図は、SPAの一般的な実施手順を示しています。
例としてアデノシンA1受容体導入細胞の細胞膜を使用したSPAのプロトコルを示します。 GDP、MgCl2、サポニン、ビーズ、および細胞膜の最適濃度は受容体ごとに異なることに注意してください。
アッセイの最適化
GDP、MgCl2の濃度:
以下の4パターンをテストします。
MgCl2:1mM、3mM、10mM、30mM
GDP:1µM、3µM、10µM、30µM
トリプリケートで実験すべきです。無刺激コントロール(アゴニスト無し)と刺激コントロール(高濃度アゴニスト)を設定します。一般的な推奨事項として、1ウェルあたり10μgの細胞膜と0.5 mgのビーズを使用して実験します(96ウェルフォーマット、100μL/ウェル)。
細胞膜およびSPAビーズの濃度:
3つのランダムな細胞膜濃度 (例:1ウェルあたり5、10、15 µg)とビーズ濃度(例:1ウェルあたり0.25、0.5、1mg)を試してください。*1ウェルの容積が100 µL/ウェルの場合
最適化された条件下でのアゴニスト、アンタゴニストの用量反応:
アゴニストの10倍希釈系列を作成します(広範囲のアゴニスト濃度をカバーする必要があります)。アンタゴニストの用量反応については、EC80(80%活性値)と同等のアゴニスト濃度を使用してください。
35S-γ-GTP結合アッセイの推奨条件
GPCRごとの推奨条件については、こちらをご参照下さい。
その他の情報
・ラットのアデノシンA1受容体膜を使用したFiltrationおよびSPAアッセイの比較
・アデノシンA1受容体トランスフェクト細胞の細胞膜を使用したSPAアッセイのサンプルプロトコル
ヒント
・SPAアッセイでは、細胞膜濃度とビーズ濃度が重要です。これらのパラメーターは、アッセイごとに最適化する必要があります
・GTP結合アッセイの場合、ポリエチレンイミン(PEI)コーティングSPAビーズの使用はお勧めしません。
・SPAアッセイは、Gi共役型GPCRで最もよく機能します。
・SPAアッセイは、アッセイバッファー中のGDP濃度、35S-γ-GTP、Mg2 +の濃度に特に影響を受けます。
・アッセイの際には、通常状態でのGTP結合レベルを決定するために適切なコントロール実験をすることが重要です。
データ分析
詳細はこちらをご覧ください。
